سدیم هیدروکسید کد 106498
سدیم هیدروکسید کد 106498 یک ترکیب قلیایی قوی با فرمول شیمیایی NaOH است که بهعنوان یک ماده صنعتی پرکاربرد شناخته میشود. این ترکیب به شکل جامد سفیدرنگ و بلوری بوده و معمولاً بهصورت پرک، گرانول یا محلول در آب عرضه میشود. سدیم هیدروکسید در تماس با آب بهراحتی حل شده و گرمای زیادی آزاد میکند که این ویژگی آن را به یک باز قوی و خورنده تبدیل میکند.
این ماده در صنایع مختلف ازجمله تولید صابون، کاغذ، پارچه، مواد شوینده، و فرآیندهای شیمیایی مورد استفاده قرار میگیرد. در صنایع نفت و گاز نیز برای تصفیه نفت خام به کار میرود. همچنین، در تصفیه آب، تولید آلومینیوم و سنتز ترکیبات آلی نقش دارد.
سدیم هیدروکسید به دلیل خاصیت خورندگی بالا، میتواند موجب آسیبهای جدی به پوست، چشم و دستگاه تنفسی شود. بنابراین، هنگام کار با آن باید از تجهیزات ایمنی مناسب مانند دستکش، عینک و ماسک استفاده کرد. این ترکیب در شرایط مناسب باید در ظروف مقاوم به مواد شیمیایی، دور از رطوبت و در مکانی خشک نگهداری شود تا از واکنشهای ناخواسته جلوگیری گردد.
هیدروکسید کد 106498
سدیم هیدروکسید کد 106498 یکی از محصولات مرک آلمان می باشد. این ماده شیمیایی به عنوان سودا و سوز سود آور شناخته می شود، این محصول یک ترکیب غیر آلی با فرمول NaOH است. این ترکیب شیمیایی یک محصول یونی و جامد سفید رنگ است که از کاتیون های سدیم + Na و آنیون های هیدروکسید -OH تشکیل شده است. سدیم هیدروکسید یک پایه بسیار سوزاننده و قلیایی است که در دمای محیط معمولی پروتئین ها را تجزیه می کند و ممکن است باعث سوختگی شدید شیمیایی شود. سدیم هیدروکسید کد 106498.
این ماده یک محلول در آب است و به سادگی رطوبت و دی اکسید کربن هوا را جذب می کند.”هیدروکسید سدیم” که از نظر تجاری در دسترس می باشد. هیدروکسید سدیم غالباً به شکل مونو هیدرات می باشد. به عنوان یکی از ساده ترین هیدروکسیدها، این هیدروکسید اغلب در کنار آب خنثی و اسید هیدروکلریدریک برای نشان دادن مقیاس pH به دانشجویان شیمی استفاده می شود. سدیم هیدروکسید کد 106498. خرید سدیم هیدروکسید
مشخصات محصول
- نام: سدیم هیدروکسید
- نام لاتین: Sodium hydroxide
- کد: 106498
- بسته بندی: 500 گرمی – 1 کیلویی – 5 کیلویی
- فرمول شیمیایی: NaOH
- وزن مولکولی: 40 گرم در مول
- حلالیت: 1090 گرم بر لیتر
- دمای ذوب: 318 درجه سانتیگراد
- دمای جوش: – درجه سانتیگراد
- خلوص: 99درصد
- شکل ظاهری: قرص های سفید رنگ
- دمای نگهداری: 2 تا 30 درجه سانتیگراد
کاربرد سدیم هیدروکسید کد 106498
سدیم هیدروکسید یک باز قوی محبوب است که در صنعت استفاده می شود. هیدروکسید سدیم در ساخت نمک ها و شوینده های سدیم، تنظیم pH و سنتز آلی استفاده می شود. به صورت فله، بیشتر اوقات به عنوان یک محلول آبی مورد استفاده قرار می گیرد. زیرا محلول ها ارزان تر اداره می شوند. هیدروکسید سدیم در بسیاری از سناریوها استفاده می شود که برای افزایش قلیائیت مخلوط یا خنثی سازی اسیدها مطلوب است.
همچنین از این ماده برای ساخت صابون و شوینده ها استفاده می گردد. این ترکیب برای ساخت صابون سخت کاربرد دارد در حالی که از هیدروکسید پتاسیم در ساخت و تولید صابون مایع استفاده می شود زیرا ارزان تر است و مقدار کمتری از این ترکیب برای تولید استفاده دارد. سدیم هیدروکسید کد 106498.
از این محصول به عنوان پاک کننده های تخلیه استفاده می گردد که حامل سدیم هیدروکسید باشد زیرا چربی ها و چربی هایی را که می تواند منجر به مسدود شدن لوله ها گردد را به صابون تبدیل کند که در آب محلول است.
موارد مصرف سدیم هیدروکسید کد106498
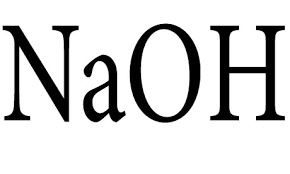
- تولید مواد شیمیایی
- تولید ابریشم مصنوعی
- تولید خمیر کاغذ
- تولید رنگ، مواد پتروشیمی و پارچه
- در تولید صابون و مواد شوینده
- تعیین غلظت اسیدهای مجهول در تیتراسیون اسید-باز
سدیم هیدروکسید کد 106498
هیدروکسید سدیم، همچنین به عنوان لیوان و سود سوزآور شناخته می شود، یک ترکیب معدنی با فرمول NaOH است. این یک ترکیب یونی جامد سفید است که از کاتیون های سدیم Na+ و آنیون های هیدروکسید OH- تشکیل شده است.
هیدروکسید سدیم یک پایه و قلیایی بسیار خورنده است که پروتئین ها را در دمای معمولی محیط تجزیه می کند و ممکن است باعث سوختگی شدید شیمیایی شود. در آب بسیار محلول است و به راحتی رطوبت و دی اکسید کربن را از هوا جذب می کند. این یک سری از هیدرات های NaOH·nH2O را تشکیل می دهد. سدیم هیدروکسید کد 106498.
مونوهیدرات NaOH·H2O از محلول های آب بین 12.3 تا 61.8 درجه سانتی گراد متبلور می شود. “هیدروکسید سدیم” موجود تجاری اغلب این مونوهیدرات است و داده های منتشر شده ممکن است به جای ترکیب بی آب به آن اشاره کنند.
به عنوان یکی از ساده ترین هیدروکسیدها، هیدروکسید سدیم اغلب در کنار آب خنثی و اسید هیدروکلریک اسیدی برای نشان دادن مقیاس pH به دانشجویان شیمی استفاده می شود. سدیم هیدروکسید کد 106498.
هیدروکسید سدیم در بسیاری از صنایع استفاده می شود: در ساخت خمیر چوب و کاغذ، منسوجات، آب آشامیدنی، صابون ها و مواد شوینده و به عنوان پاک کننده فاضلاب. تولید جهانی در سال 2004 تقریباً 60 میلیون تن بود، در حالی که تقاضا 51 میلیون تن بود.
خواص سدیم هیدروکسید کد 106498
مشخصات فیزیکی سدیم هیدروکسید
هیدروکسید سدیم خالص یک جامد کریستالی بی رنگ است که در دمای 318 درجه سانتیگراد (604 درجه فارنهایت) بدون تجزیه و با نقطه جوش 1388 درجه سانتیگراد (2530 درجه فارنهایت) ذوب می شود. در آب بسیار محلول است و در حلال های قطبی مانند اتانول و متانول حلالیت کمتری دارد. هیدروکسید سدیم در اتر و سایر حلال های غیر قطبی نامحلول است.
مشابه هیدراتاسیون اسید سولفوریک، انحلال هیدروکسید سدیم جامد در آب یک واکنش بسیار گرمازا است که در آن مقدار زیادی گرما آزاد میشود و از طریق احتمال پاشش، خطری برای ایمنی ایجاد میکند. محلول حاصل معمولا بی رنگ و بی بو است. مانند سایر محلول های قلیایی، به دلیل فرآیند صابونی شدن که بین NaOH و روغن های طبیعی پوست رخ می دهد، در تماس با پوست احساس لغزنده می کند. سدیم هیدروکسید کد 106498.
ویسکوزیته
محلول های آبی غلیظ (50%) هیدروکسید سدیم دارای ویسکوزیته مشخصه 78 mPa·s، که بسیار بیشتر از آب (1.0 mPa·s) و نزدیک به روغن زیتون (85 mPa·s) در دمای اتاق است. ویسکوزیته NaOH آبی، مانند هر ماده شیمیایی مایع، با دمای سرویس آن رابطه معکوس دارد، یعنی با افزایش دما، ویسکوزیته آن کاهش می یابد و بالعکس. ویسکوزیته محلول های هیدروکسید سدیم نقش مستقیمی در کاربرد و همچنین ذخیره سازی آن دارد.
هیدراته ها
هیدروکسید سدیم می تواند چندین هیدرات NaOH·nH2O را تشکیل دهد که منجر به یک نمودار حلالیت پیچیده می شود که توسط Spencer Umfreville Pickering در سال 1893 به تفصیل شرح داده شد. هیدرات های شناخته شده و محدوده تقریبی دما و غلظت (درصد جرمی NaOH) محلول های آب اشباع آنها عبارتند از: سدیم هیدروکسید کد 106498
هپتاهیدرات، NaOH·7H2O: از -28 درجه سانتی گراد (18.8٪) تا -24 درجه سانتی گراد (22.2٪).
پنتاهیدرات، NaOH·5H2O: از -24 درجه سانتیگراد (22.2٪) تا -17.7 (24.8٪).
تتراهیدرات، NaOH·4H2O، فرم α: از -17.7 (24.8٪) تا +5.4 درجه سانتیگراد (32.5٪).
تتراهیدرات، NaOH·4H2O، فرم β: فراپایدار.
تری همی هیدرات، NaOH·3.5H2O: از +5.4 درجه سانتیگراد (32.5٪) تا +15.38 درجه سانتیگراد (38.8٪) و سپس به +5.0 درجه سانتیگراد (45.7٪).
تری هیدرات، NaOH·3H2O: فراپایدار.
دی هیدرات، NaOH·2H2O: از +5.0 درجه سانتیگراد (45.7٪) تا +12.3 درجه سانتیگراد (51٪).
مونوهیدرات، NaOH·H2O: از +12.3 درجه سانتیگراد (51٪) تا 65.10 درجه سانتیگراد (69٪) سپس به 62.63 درجه سانتیگراد (73.1٪).
گزارشهای اولیه به هیدراتهایی با n = 0.5 یا n = 2/3 اشاره میکنند، اما تحقیقات دقیق بعدی وجود آنها را تأیید نکرد.
تنها هیدرات های دارای نقطه ذوب پایدار NaOH·H2O (65.10 درجه سانتیگراد) و NaOH·3.5H2O (15.38 درجه سانتیگراد) هستند. هیدرات های دیگر، به جز هیدرات های ناپایدار NaOH·3H2O و NaOH·4H2O (β) می توانند از محلول هایی با ترکیب مناسب، همانطور که در بالا ذکر شد، متبلور شوند. با این حال، محلولهای NaOH را میتوان بهراحتی با درجات زیادی فوقسرد کرد، که اجازه میدهد هیدراتها (از جمله آنهایی که ناپایدار هستند) از محلولهایی با غلظتهای مختلف تشکیل شوند.
به عنوان مثال، هنگامی که محلولی از NaOH و آب با نسبت مول 1:2 (52.6٪ NaOH بر وزن) سرد می شود، مونوهیدرات معمولاً قبل از دی هیدرات شروع به متبلور شدن می کند (در حدود 22 درجه سانتیگراد). با این حال، محلول را می توان به راحتی تا دمای -15 درجه سانتی گراد فوق سرد کرد، در این نقطه ممکن است به سرعت به صورت دی هیدرات متبلور شود.
هنگامی که گرم می شود، دی هیدرات جامد ممکن است به طور مستقیم به محلولی در 13.35 درجه سانتیگراد ذوب شود. با این حال، زمانی که دما از 12.58 درجه سانتیگراد فراتر رفت. اغلب به مونوهیدرات جامد و محلول مایع تجزیه می شود. حتی n=3.5 هیدرات نیز به سختی متبلور می شود، زیرا محلول آنقدر فوق سرد می شود که هیدرات های دیگر پایدارتر می شوند.
محلول آب گرم حاوی 73.1٪ (جرم) NaOH یک یوتکتیک است که در حدود 62.63 درجه سانتیگراد به عنوان مخلوطی از کریستال های بی آب و مونوهیدرات جامد می شود.
دومین ترکیب یوتکتیک پایدار 45.4% (جرم) NaOH است که در حدود 4.9 درجه سانتیگراد به مخلوطی از کریستالهای دی هیدرات و 3.5 هیدرات جامد می شود. سدیم هیدروکسید کد 106498.
سومین یوتکتیک پایدار دارای 18.4 درصد (جرم) NaOH است.
در حدود -28.7 درجه سانتیگراد به عنوان مخلوطی از یخ آب و هپتاهیدرات NaOH·7H2O جامد می شود.
هنگامی که محلول های با کمتر از 18.4٪ NaOH سرد می شوند، یخ آب ابتدا متبلور می شود و NaOH را در محلول باقی می گذارد.
شکل α تتراهیدرات دارای چگالی 1.33 گرم بر سانتی متر مکعب است. در دمای 7.55 درجه سانتیگراد به طور همزمان ذوب می شود و به مایعی با 35.7 درصد NaOH و چگالی 1.392 گرم بر سانتی متر مکعب تبدیل می شود و بنابراین مانند یخ روی آب روی آن شناور می شود. با این حال، در حدود 4.9 درجه سانتیگراد ممکن است به طور نامتجانس به مخلوطی از NaOH·3.5H2O جامد و محلول مایع تبدیل شود.
فرم بتا تتراهیدرات متاستیکر است و اغلب وقتی در دمای زیر 20- درجه سانتیگراد سرد می شود، خود به خود به شکل α تبدیل می شود. پس از شروع، تبدیل گرمازا در چند دقیقه کامل می شود، با افزایش 6.5 درصدی حجم جامد. فرم β را می توان از محلول های فوق سرد در دمای 26- درجه سانتی گراد متبلور کرد و تا حدی در دمای 83/1- درجه سانتی گراد ذوب شد.
“هیدروکسید سدیم” تجارت اغلب مونوهیدرات است (چگالی 1.829 گرم بر سانتی متر مکعب). داده های فیزیکی در ادبیات فنی ممکن است به این شکل اشاره داشته باشد تا ترکیب بی آب. سدیم هیدروکسید کد 106498.
ساختار کریستالی سدیم هیدروکسید کد 106498
NaOH و مونوهیدرات آن به ترتیب با گروه های فضایی Cmcm (oS8) و Pbca (oP24)، کریستال های متعامد را تشکیل می دهند. ابعاد سلول مونوهیدرات a = 1.1825، b = 0.6213، c = 0.6069 نانومتر است. اتمها در ساختار لایهای هیدرارژیلیت مانند قرار گرفتهاند که هر اتم سدیم توسط شش اتم اکسیژن احاطه شدهاند که هر کدام سه اتم از یونهای هیدروکسید و سه اتم از مولکولهای آب هستند. اتم های هیدروژن هیدروکسیل ها پیوندهای قوی با اتم های اکسیژن در هر لایه O ایجاد می کنند. لایه های O مجاور توسط پیوندهای هیدروژنی بین مولکول های آب در کنار هم نگه داشته می شوند.
خواص شیمیایی سدیم هیدروکسید کد 106498
واکنش با اسیدها سدیم هیدروکسید کد 106498
هیدروکسید سدیم با اسیدهای پروتیک واکنش داده و آب و نمک های مربوطه را تولید می کند. به عنوان مثال، هنگامی که هیدروکسید سدیم با اسید هیدروکلریک واکنش می دهد، کلرید سدیم تشکیل می شود:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
به طور کلی، چنین واکنش های خنثی سازی با یک معادله یونی خالص ساده نشان داده می شود:
OH−(aq) + H+(aq) → H2O(l)
این نوع واکنش با اسید قوی گرما آزاد می کند و از این رو گرمازا است. چنین واکنش های اسید-باز می تواند برای تیتراسیون نیز استفاده شود. با این حال، هیدروکسید سدیم به عنوان یک استاندارد اولیه استفاده نمی شود، زیرا رطوبت سنجی است و دی اکسید کربن را از هوا جذب می کند. سدیم هیدروکسید کد 106498.
واکنش با اکسیدهای اسیدی
هیدروکسید سدیم همچنین با اکسیدهای اسیدی مانند دی اکسید گوگرد واکنش می دهد. چنین واکنش هایی اغلب برای پاک کردن گازهای اسیدی مضر (مانند SO2 و H2S) تولید شده در سوزاندن زغال سنگ و در نتیجه جلوگیری از انتشار آنها در جو استفاده می شود. مثلا،
2 NaOH + SO2 → Na2SO3 + H2O
واکنش سدیم هیدروکسید کد 106498 با فلزات و اکسیدها
شیشه به آرامی با محلول های آبی هیدروکسید سدیم در دمای محیط واکنش می دهد و سیلیکات های محلول را تشکیل می دهد. به همین دلیل، اتصالات شیشه ای و شیرهای متوقف کننده در معرض هیدروکسید سدیم تمایل به “یخ زدن” دارند. فلاسک ها و راکتورهای شیمیایی با روکش شیشه ای در اثر قرار گرفتن طولانی مدت در معرض هیدروکسید سدیم داغ آسیب می بینند که شیشه را نیز یخ می زند.
هیدروکسید سدیم در دمای اتاق به آهن حمله نمی کند، زیرا آهن خاصیت آمفوتریک ندارد (یعنی فقط در اسید حل می شود، نه باز). با این وجود، در دماهای بالا (به عنوان مثال بالای 500 درجه سانتیگراد)، آهن می تواند به صورت گرماگیر با هیدروکسید سدیم واکنش داده و اکسید آهن (III)، فلز سدیم و گاز هیدروژن را تشکیل دهد.
این به دلیل آنتالپی کمتر تشکیل اکسید آهن (III) (-824.2 کیلوژول بر مول) در مقایسه با هیدروکسید سدیم (-500 کیلوژول بر مول) و تغییر آنتروپی مثبت واکنش است که به معنای خودبخودی در دماهای بالا است (ΔST > ΔH). ، ΔG <0) و غیر خود به خودی در دماهای پایین (ΔST < ΔH، ΔG > 0). واکنش زیر را بین هیدروکسید سدیم مذاب و براده های آهن ریز تقسیم شده در نظر بگیرید:
4 Fe + 6 NaOH → 2 Fe2O3 + 6 Na + 3 H2
با این حال، برخی از فلزات واسطه ممکن است تحت شرایط ملایم تر به شدت با هیدروکسید سدیم واکنش نشان دهند.
در سال 1986، یک تانکر جاده ای آلومینیومی در بریتانیا به اشتباه برای انتقال محلول هیدروکسید سدیم 25 درصد استفاده شد، [23] که باعث تحت فشار قرار دادن محتویات و آسیب به تانکر شد. فشار ناشی از گاز هیدروژن است که در واکنش بین هیدروکسید سدیم و آلومینیوم تولید می شود: سدیم هیدروکسید کد 106498
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
رسوب دهنده
بر خلاف هیدروکسید سدیم که محلول است، هیدروکسیدهای اکثر فلزات واسطه نامحلول هستند و بنابراین می توان از هیدروکسید سدیم برای رسوب هیدروکسیدهای فلزات واسطه استفاده کرد. رنگ های زیر مشاهده می شود:
- مس – آبی
- آهن (II) – سبز
- آهن (III) – زرد / قهوه ای
نمک های روی و سرب در هیدروکسید سدیم اضافی حل می شوند و محلول شفافی از Na2ZnO2 یا Na2PbO2 به دست می آورند. سدیم هیدروکسید کد 106498. سدیم هیدروکسید کد 106498
هیدروکسید آلومینیوم به عنوان یک لخته کننده ژلاتینی برای فیلتر کردن ذرات معلق در تصفیه آب استفاده می شود. هیدروکسید آلومینیوم در تصفیه خانه از سولفات آلومینیوم با واکنش آن با هیدروکسید سدیم یا بی کربنات تهیه می شود.
Al2(SO4)3 + 6 NaOH → 2 Al(OH)3 + 3 Na2SO4
Al2(SO4)3 + 6 NaHCO3 → 2 Al(OH)3 + 3 Na2SO4 + 6 CO2
کاربرد سدیم هیدروکسید کد 106498 صابون سازی
هیدروکسید سدیم را می توان برای هیدرولیز مبتنی بر پایه استرها (مانند صابون سازی)، آمیدها و آلکی ها استفاده کرد.
قیمت – فروش سدیم هیدروکسید کد 106498
شرکت دانش پژوهان شیمی یکی از بزرگترین وارد کنندگان و فروشندگان مواد شیمیایی و آزمایشگاهی بخصوص سدیم هیدروکسید کد 106498 می باشد. این شرکت در زمینه واردات این محصولات از تجربه بسیار بالایی برخوردار است. شما می توانید جهت تهیه این محصولات (اصلی) با بخش فروش شرکت تماس گرفته و با کارشناسان این شرکت در ارتباط باشید.
یا از طریق کانال واتساپ شرکت نام محصول به همراه میزان نیاز خود را ارسال تا در کمترین زمان پاسخ استعلام خود را دریافت نمائید.امیدواریم بتوانیم با ارائه محصولات اصلی و با بهترین کیفیت شما را برای رسیدن به اهدافتان یاری نمائیم.
جهت محصولات بیشتر واستعلام سریع قیمت سدیم هیدروکسید کد 106498 میتوانید از طریق کانال واتساپ شرکت با ارسال نام ماده و مقدار نیاز در کمترین زمان پاسخ استعلام خود را دریافت نمائید. سدیم هیدروکسید کد 106498.
راههای ارتباطی
شماره های تماس:
021-66859216
021-66859220 (ساعات تماس:8.30 الی 19)
واتساپ:09129618292 (24ساعت)
Last Updated on 03/08/2025 by adminm
